|
睡眠呼吸暂停是慢性肾脏病的一个危险因素吗?
加拿大卡尔加里大学医学院Patrick J. Hanly医学博士等就睡眠呼吸暂停和肾脏疾病发表了一篇综述,文章于近期发表于Chest杂志上,现全文编译如下。
慢性肾脏疾病(CKD)患病率的不断增加对患者和医疗系统都是一种挑战。虽然CKD的高患病率与糖尿病、高血压、肥胖等患病率的增长密切相关,但是睡眠呼吸暂停和夜间低氧血症在CKD发病机制和肾功能衰竭的病程中也起着重要的作用。
CKD的两个病理生理机制:肾小球高滤过和慢性肾脏缺氧,都会导致肾小管间质受损,最终导致终末期肾脏疾病(ESKD)的发生。多个描述性研究已证实,睡眠呼吸暂停和CKD之间存在关联。虽然CKD患者中常有睡眠呼吸暂停、且往往伴随显著夜间低氧血症,但这些CKD患者往往没有睡眠呼吸暂停相关症状,这使得有目的的夜间监测难以进行。
然而,睡眠呼吸暂停和夜间低氧血症往往会导致肾功能下降和受损,这表明睡眠呼吸暂停、夜间低氧血症与导致肾功能恶化的发病机制之间联系密切。
睡眠呼吸暂停可通过数条通路来导致肾功能恶化,包括:肾脏缺氧的直接影响和全身及肾脏的肾素-血管紧张素系统激活。有必要进行进一步研究来更好的理解他们之间的相互关系,同时明确哪些具体干预措施可改善睡眠呼吸暂停患者的临床转归,如降低CKD患病率、延缓其进展为ESKD。
众所周知,ESKD患者中睡眠呼吸暂停的患病率较高,且往往病情较重;这可能是由于呼吸中枢的不稳定和睡眠时上气道受阻所导致。睡眠呼吸暂停是ESKD患者的一个重要合并症,会导致日间嗜睡,增加心血管疾病的发病率和死亡率。
最近,阻塞性睡眠呼吸暂停(OSA)对CKD病程进展的潜在影响越来越受到了大众的关注。不少研究指出,睡眠呼吸暂停和肾脏疾病之间可能存在一个双向互为因果的关联。
过去十年间,全球CKD患病率增长迅速,特别在老年人中。超过10%的成年人是CKD患者,大于60岁人群中这一数字可上升至20%,大于 70岁人群中这一数字可上升至35%。CKD患病率的快速增长往往与糖尿病、高血压和肥胖的患病率不断增长密切相关,但这些慢性疾病的高患病率并不能完全解释CKD患病率的增加情况。
虽然漏诊睡眠呼吸暂停很常见,但在过去的20年间,睡眠呼吸暂停的患病率还是出现了急剧增加。睡眠呼吸暂停通过肾脏缺氧的直接作用以及氧化应激、内皮功能障碍、炎症细胞因子水平、交感神经活性和全身血压水平增加的间接作用来导致肾脏疾病的进展、肾功能下降。
肾功能下降会使心血管发病率和死亡率增加,而CKD进展至肾脏替代治疗会产生巨大的经济负担。因此对于临床工作者和卫生政策制定者来说,有必要更好的理解睡眠呼吸暂停对肾脏功能影响的潜在作用。
这篇综述会详细介绍肾脏疾病的发病机制、CKD患者中睡眠呼吸暂停的患病率、睡眠呼吸暂停对肾功能的潜在影响、睡眠呼吸暂停导致肾功能损伤的机制。
肾脏疾病的发病机制
从概念上讲,肾脏可以被认为是由两个功能不同、但解剖结构相连的两个区域所构成,包括主要在肾皮质的肾小球和主要在髓质的肾小管(图1)。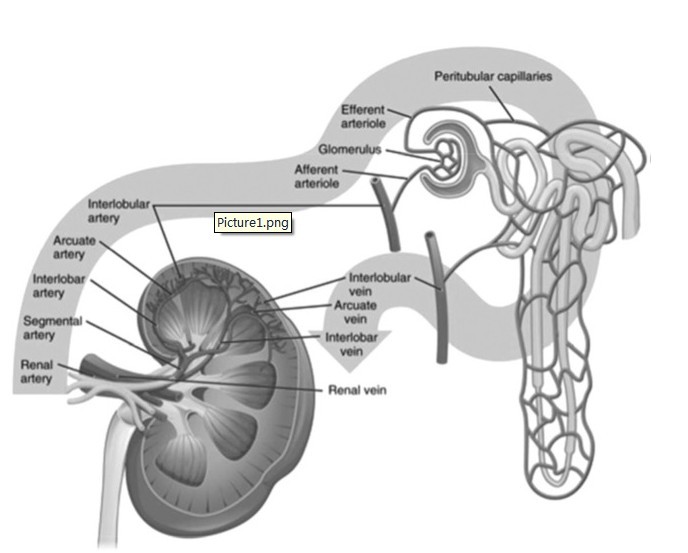
图1:肾脏的解剖。
来自小叶间动脉的血流通过入球小动脉到达肾小球毛细血管网。出球小动脉经管周毛细血管网,通过小叶间静脉,离开肾脏。尿液通过肾小球滤过、肾小管重吸收、集合管系统转运至输尿管。
CKD往往是由不同的肾脏损伤所引起。一旦损伤达到临界阈值,额外的肾脏生理负担,即使和最初的肾脏损伤不相同,也会推动疾病进展、导致肾功能衰竭。肾小球的高滤过学说和肾小管的慢性缺氧假说是CKD的主要发病机制。
肾小球高滤过学说是由Brenner等在1982年提出的。其产生机理是,当大量肾单位破坏时,会导致残余肾单位活动代偿性增加以维持清除率和肾小球滤过率(GFR)在正常范围内。肾小球高滤过是通过扩张入球小动脉而获得,这会增加肾血流量和肾小球毛细血管压力。
虽然在短期内可以维持GFR在正常范围内,但长期来说,这会损害肾小球导致肾小球硬化。此外,肾小球毛细血管高压会影响肾小球滤过功能,导致蛋白负荷增加,刺激肾间质炎症和纤维化的发生。
虽然肾小球高压是CKD的一个重要发病机制,但是肾小管和肾间质损伤(肾小管间质损伤)更容易导致肾功能不全的发生。事实上,已有研究指出,不管何种原因导致的ESKD,最终均会表现为肾小管间质损伤(部分是由于慢性缺氧所致)。
肾脏血供丰富,相当于心输出量的20%;但由于解剖和生理原因,只有10%的肾脏血液供应肾髓质。从解剖学角度来看,肾髓质离开血管相对较远,而这些血管能提供肾脏氧气,因此肾髓质的氧供也相应减少。从生理学角度,肾小管参与的逆流倍增机制通过直小血管提供了一个氧气的动静脉分流,使氧供减少。
肾髓质由于这些解剖和生理因素导致氧供较低,在出现正常肾脏生理活动间歇性高耗氧时,如:钠的主动重吸收,低氧供会进一步加重。有限的基础较低的氧供和肾髓质高耗氧之间的需求不平衡会导致肾脏对于缺氧的损害异常敏感和脆弱。已有研究证明,肾组织缺氧和CKD发生密切相关(图2)。
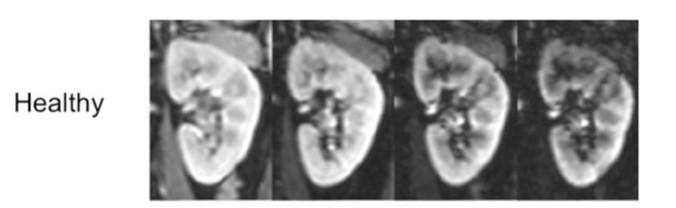
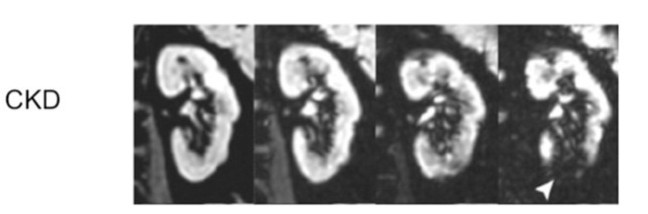
图2:肾脏MRI来反映肾脏血氧依赖情况。图上显示的是一个CKD患者和一个健康受试者的T2影像。在健康受试者中,MRI的影像是均一的,且随着时间而逐渐减弱。在CKD患者中,MRI的影像表现出更多形态。许多区域,信号是快速减弱(箭头所指),提示这些区域存在着严重的缺氧。CKD = 慢性肾脏疾病。
动物试验中发现,肾组织缺氧会导致蛋白尿的发生,且这一过程独立于其他血流动力学和生化指标因素。已有研究指出,肾实质可通过两条通路对缺氧做出应答,包括由缺氧所介导的保护性通路和非缺氧所诱导、潜在的有害通路,如肾脏-血管紧张素系统(RAS)。
CKD合并睡眠呼吸暂停的患病率
鉴于低氧对肾脏疾病进展的潜在影响作用,不少研究开始关注CKD合并睡眠呼吸暂停的患病率。广义上来讲,基于这些受试者招募的不同,这些研究可以被分为3类:(1)研究直接评估CKD患者中睡眠呼吸暂停情况的;(2)研究评估睡眠呼吸暂停患者中CKD情况的;(3)研究评估数据库,来了解睡眠呼吸暂停和CKD之间的关联。
1)CKD患者中睡眠呼吸暂停的患病率
Markou等研究中招募了35名患者,估计GFR(eGFR)为26.8±9.2mL/min/1.73m2。研究发现,31.4%患者有OSA(通过多导睡眠监测[PSG],睡眠呼吸暂停低通气指数[AHI]>15)。AHI和血尿素水平呈正相关;没有糖尿病的患者中,AHI和eGFR水平呈正相关。
Sakaguchi等研究中招募了100名有CKD的日本男性患者(eGFR,28.5mL/min/1.73m2;eGFR范围从8-40mL/min/1.73m2)。研究通过一个3型便携式监护仪进行评估,研究发现33%的受试者有中重度OSA(AHI>15)。多变量Logistic回归分析显示,eGFR每下降10mL/min/1.73m2,OSA的可能性增加42%,且和年龄、身体质量指数(BMI)和糖尿病无关。
Rouymelioti等研究中将89名CKD患者(eGFR为18.9±7.6mL/min/1.73m2)和224对照组进行比较(社区队列,eGFR,91.8±19.2mL/min/1.73m2),通过家用PSG评估睡眠呼吸暂停情况。研究发现,相较对照组,CKH患者的重症睡眠呼吸暂停(AHI≥30)患病率显著增高(CKD组 22.5%,对照组 11.5%)。
Nicholl等在随后进行的研究中,评估了254名肾功能水平不等的患者,研究将受试者分为3组:eGFR >60mL/min/1.73m2组、CKD组(eGFR<60mL/min/1.73m2,但不需要透析)、ESKD组(需行血透)。研究中通过3型便携式监护仪来评估睡眠呼吸暂停(睡眠呼吸暂停,定义为呼吸紊乱指数[RDI]≥15)。
研究发现,随着eGFR水平的下降,睡眠呼吸暂停的患病率也不断增加(eGFR >60mL/min/1.73m2组,患病率27%;CKD组,患病率41%;ESKD组, 患病率57%)(图3)。此外,CKD组和ESKD组患者中夜间低氧血症的患病率也较高(图4)。
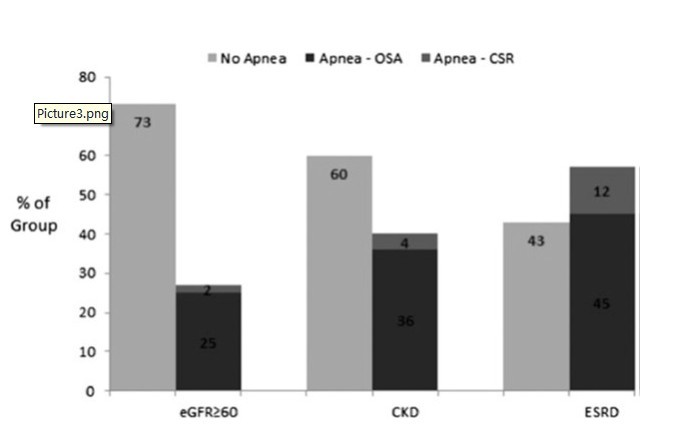
图3:CKD和ESRD患者中睡眠呼吸暂停的患病率。受试者分为3组:eGFR ≥60mL/min/1.73m2,CKD组和ESRD组。睡眠呼吸暂停患病率随着eGFR水平的下降而不断增加(eGFR≥60组,患病率:27%;CKD组,患病率:41%;ESRD组:57%)。CSR = 潮式呼吸(呼吸特征性的表现为渐强/渐弱模式,没有气流受限);eGFR = 估计的肾小球滤过率;ESRD = 终末期肾病
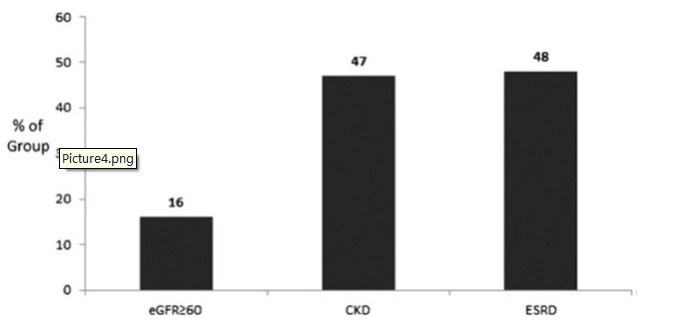
图4:CKD患者中夜间低氧血症的患病率。夜间低氧血症定义为:在≥12%的记录时间内,平均动脉氧饱和度<90%。受试者分为3组:eGFR ≥60mL/min/1.73m2,CKD组和ESRD组。eGFR ≥60mL/min/1.73m2组中,夜间低氧血症的患病率为16%,CKD组中患病率为47%,ESRD组中患病率为48%。
2)睡眠呼吸暂停患者中CKD的患病率
Kanbay等对疑似睡眠呼吸暂停的175名患者进行了整夜PSG,所有患者都评估了eGFR。这些患者根据AHI水平分为四组:第一组,AHI<5;第二组,AHI 5-15;第三组,AHI 15-30;第四组,AHI>30。
研究发现四组的eGFR均有显著下降(第一组50±11.8 mL/min/1.73m2;第二组44.8±15.9 mL/min/1.73m2;第三组40.8±14.7 mL/min/1.73m2;第四组33.8±16mL/min/1.73m2)。Chou等通过PSG评估了40名患者的睡眠呼吸暂停情况。
研究发现,这些患者的平均AHI是51.6±39.2,平均eGFR是85.4±18.3mL/min/1.73m2。重症OSA患者(AHI>30)中,CKD的患病率是18%。多变量回归分析显示AHI和eGFR呈显著相关。
Iseki等针对一个睡眠呼吸暂停数据库中的4056名患者进行了评估;这些患者行PSG,AHI均≥5。这些患者中,1624名随访了血肌酐,得到eGFR。研究发现30.5%的睡眠呼吸暂停患者(AHI,45.3±33.3)合并CKD(eGFR<60mL/min/1.73m2)。
将这些患者与年龄和性别匹配的社区对照组进行比较,这些患者CKD的相对危险度(OR)为4.542。Fleischmann等对疑似睡眠呼吸暂停患者进行了整夜PSG和eGFR评估。
研究发现,相比那些没有睡眠呼吸暂停的患者,睡眠呼吸暂停患者(AHI>5)eGFR水平更低(睡眠呼吸暂停组eGFR:84.5±7mL/min/1.73m2,没有睡眠呼吸暂停组eGFR:94.6±7mL/min/1.73m2)。
3)数据库中睡眠呼吸暂停和CKD的关联
Canales等在老年人睡眠障碍(MrOS Sleep)研究中,评估了2696名老年人(平均年龄,73岁)的睡眠呼吸暂停患病率(使用家用PSG)和eGFR水平。研究发现,27%的受试者有睡眠障碍(AHI≥15),15%的受试者eGFR<60 mL/min/1.73m2,但是eGFR和AHI之间不存在关联。
Sim等针对一个大规模保健数据库的1377427名成年人进行了一次横截面研究,所有研究对象在3年中都至少随访过一次血肌酐。该研究根据数据库中的资料进行睡眠呼吸暂停的诊断,使用eGFR水平来评估肾功能。
研究发现,总的睡眠呼吸暂停患病率较低(2.5%),这是因为该研究对象同时包括了正常肾功能人群(eGFR >60mL/min/1.73m2)和CKD患者。但相较肾功能正常人群,eGFR水平在45到59mL/min/1.73m2的受试者,睡眠呼吸暂停的OR更高;且不受年龄、性别和相关合并症(糖尿病、心衰和高血压)的影响。
CKD合并睡眠呼吸暂停患者的临床特点
睡眠相关症状在CKD患者中很常见。Murtagh等针对66名接受保守治疗的CKD 5期患者(eGFR:11.2±2.8mL/min/1.73m2,未透析)进行了一个横截面研究,研究使用了患者自我报告的调查问卷形式(记忆症状评估量表简表),问卷中补充了肾脏相关症状。研究发现,41%的患者有入睡困难,65%的患者有日间嗜睡。
值得注意的是,该研究对象为老年人(年龄:82±6.6岁),肾功能往往显著受损。随后Kumar等通过自我报告问卷形式(肾脏疾病患者生活质量),评估了689名CKD 3到5期的患者(eGFR:24.9±10.6mL/min/1.73m2)的睡眠质量(评分,0-100分)。研究发现,57%的患者睡眠质量较差(睡眠质量评分≤60分)。
因此作者得出结论,CKD患者往往睡眠质量较差。虽然导致CKD患者睡眠质量差的病因是多方面的,但不宁腿综合症占了其中很大一部分原因。有研究指出,CKD患者中不宁腿综合症的患病率高达26%,匹兹堡睡眠质量指数(PSQI)发现不宁腿综合症是睡眠质量差的独立影响因素。
当CKD患者合并OSA时,有哪些临床症状?CKD患者中合并OSA是否很常见?Nicholl等研究中招募了119名CKD患者,使用3型便携式监护仪来诊断这些患者是否合并睡眠呼吸暂停(RDI≥15时诊断为OSA)。使用Epworth嗜睡量表和PSQI来评估患者睡眠情况。
研究发现,在合并OSA和不合并OSA的患者中,OSA症状(打鼾、呼吸暂停和睡眠质量差)和PSQI得分不存在差异。相比不合并OSA的CKD患者,合并OSA的CKD患者日间嗜睡(Epworth嗜睡量表得分>10)的发生率更高(合并OSA的CKD患者39%,不合并OSA的CKD患者19%)。
然而,相比只有OSA而无肾脏疾病患者,合并OSA的CKD患者日间嗜睡和睡眠呼吸暂停症状(前面所述)明显较少。因此,很多合并OSA的CKD患者没有典型的OSA症状。研究者指出,合并OSA的CKD患者其OSA相关的临床症状往往不明显,只有通过夜间睡眠监测才能明确诊断该合并症。
该作者还研究了3种常见筛查问卷对合并OSA的CKD患者的评估情况,分别是:柏林问卷、校正颈围问卷和STOP-BANG问卷(打鼾、日间疲劳、观察到的呼吸暂停、高血压、BMI、年龄、颈围、性别)。该研究同时纳入了CKD患者(n=109)和ESKD患者(n=63)。
研究发现,38%的CKD患者和51%的ESKD患者合并OSA。对合并睡眠呼吸暂停的CKD和ESKD患者来说(RDI≥15),所有筛查量表的敏感度(56%-94%)都令人满意,但特异性较差(29%-77%)、精度较低(51%-69%)。精度是将总的正确风险评估除以总的风险评估。
如果使用一个更严格的RDI来定义睡眠呼吸暂停(RDI≥30),结果仍然是不变的。因此作者指出,目前OSA的筛查问卷不能精确的发现那些有OSA风险或合并CKD和ESKD的OSA患者。CKD患者睡眠相关障碍患病率较高,但是他们不特异的临床表现往往不足以来明确诊断睡眠呼吸障碍。
睡眠呼吸暂停对肾功能的潜在影响
两个临床研究评估了睡眠呼吸暂停和肾功能损伤之间的关系。两个研究都是针对夜间低氧血症这一指标的,而夜间低氧血症主要是由于OSA所引起的。两个研究都发现,夜间低氧血症的严重程度和肾功能下降速率之间存在关联。
Ahmed等研究中共招募了858名患者,通过诊断试验(PSG或3型便携式监测)来了解有无睡眠呼吸暂停,同时连续评估这些患者eGFR水平(平均随访2.1年)。研究中,夜间低氧血症是定义为:≥12%的记录时间内,动脉氧饱和度(SaO2)<90%,使用类似心脏健康研究量表来进行评估。
根据美国睡眠学会指南,将氧饱和度下降4%定义为一次RDI。RDI<5,正常;5到14.9,轻度OSA;15到30,中度OSA;>30,重度OSA。通过自我问卷和数据库资料对相关协变量进行了测量,包括:糖尿病、高血压、心血管疾病(心衰、中风和心肌梗塞)、慢性阻塞性肺部疾病(COPD)、哮喘、心律失常和抑郁。
研究发现,总的RDI为23±25,22±27%的睡眠时间中SaO2<90%。基线水平eGFR是71±12 mL/min/1.73m2。44%的患者有夜间低氧血症。5.7%的患者有eGFR的加速下降(定义为eGFR每年减少≥4mL/min/1.73m2,是正常的2到4倍)。
多变量Logistic回归分析显示,夜间低氧血症和肾功能快速下降之间存在关联,未调整OR是6.32。即使对年龄、BMI、糖尿病和心衰等参数进行调整后,OR仍然显著,为2.89。作者指出,夜间低氧血症是肾功能加速减退的独立相关因素。
Alhmed等研究中评估了受试者的睡眠情况,其中大多数受试者没有CKD病史。和这个研究不同,Sakaguchi等研究中通过氧饱和指数(ODI)评估了161名CKD 3到4期患者间歇性低氧血症情况。研究中将氧饱和度下降4%定义为一次ODI。
夜间低氧血症分为:无(ODI<5),轻度(ODI,5-14.9),中重度(ODI≥15)。通过评估1年内eGFR变化情况来了解肾功能减退情况。基线平均水平eGFR是31 mL/min/1.73m2。研究发现,50%的患者有夜间低氧血症,20%为中重度。
中重度夜间低氧血症患者eGFR的下降程度是无或轻度夜间低氧血症患者的3到4倍。研究发现,夜间低氧血症是肾功能下降的一个显著预测因子。
目前已有研究通过评估正压通气治疗睡眠相关呼吸障碍前后eGFR变化情况,来了解睡眠呼吸暂停和肾功能之间的联系。Kogal等评估了27名没有CKD的OSA患者,给予患者行持续气道正压通气(CPAP)治疗3个月后,再次评估。
研究发现,通过3个月的CPAP治疗后,患者的eGFR水平有轻度改善且存在统计学意义(72.9±12到79.3±17.9 mL/min/1.73m2)。然而,该研究并未评估其潜在的相关机制。
有两个研究针对自适应性伺服通气应用在合并心衰、睡眠呼吸暂停的CKD患者中的情况进行了评价。这些患者的睡眠呼吸暂停主要是由于中枢原因所引起,而不是阻塞性的。尽管如此,两个研究均发现自适应性伺服通气通过改善心脏血流动力学、降低全身交感神经活性和炎症情况可改善eGFR水平,所有这一切都有助于提高患者生存率。
睡眠呼吸暂停是如何损害肾功能的?潜在机制
OSA和CKD有很多常见且相同的合并症,这导致上述两种疾病互相关联。全身高血压、糖尿病和肥胖越来越常见;这些慢性疾病是OSA和CKD的危险因素和常见合并症。这些慢性疾病的控制不佳,特别是高血压和糖尿病,可导致CKD患者肾功能的加速减退。
然而,OSA和夜间低氧血症,可能是独立于这些并发症,而导致这些肾病疾病进展恶化的。
如果OSA确实可使肾功能恶化,那么间歇性低氧血症很可能在其中发挥了重要作用。已有研究指出,RAS系统的激活会使肾小球高滤过和全身性高血压的出现,这都会导致肾功能减退。事实上动物实验和人体研究均指出,间歇性低氧血症可激活全身RAS系统。
有研究评估了睡眠呼吸暂停和RAS系统的相互关联(人体研究)却得到了互为矛盾的结果。动物试验发现,肾脏RAS系统的激活会产生很多不同的下游影响,包括:肾小球高滤过、炎症和肾脏纤维化。
有研究评估了OSA患者中肾脏血流动力学情况。研究发现,通过CPAP治疗后,OSA患者的滤过分数(FF,肾性高血压标记)有显著改善。此外研究发现,给予患者使用血管紧张素转换酶抑制剂或血管紧张素受体阻滞剂治疗不能改善患者FF。
已有研究评估了OSA对全身和肾脏RAS系统的潜在影响,同时评价了通过CPAP治疗OSA会对全身和肾脏RAS系统产生怎样的影响。研究共招募了20名有显著夜间低氧血症(在36±5%的晚上,SaO2<90%)的OSA患者(RDI,42±4),对CPAP治疗前后均进行了评估。
研究中通过监测全身血压和RAS循环标志物,以及血压和RAS循环标志物对应用血管紧张素II(AngII)的反应来评估全身RAS系统的活性。通过监测肾脏血流动力学参数(GFR,肾血流量[RPF]和FF)和这些参数对应用AngII的反应来评估肾脏RAS系统的活性。
研究发现,CPAP治疗后,血压和血醛固酮水平明显下降。使用CPAP治疗后,血压对AngII的反应增加,这说明在未经CPAP治疗的OSA患者中,全身RAS系统的活性是明显升高的。CPAP治疗后,FF水平下降显著,这说明随着RPF的加大,肾小球毛细血管血压也随之下降。
CPAP治疗后,RPF对AngII的敏感性增高,这说明对于未经CPAP治疗的OSA患者,肾脏RAS系统的活性是明显升高的(图5)。上述发现均说明OSA患者中,肾脏和全身RAS系统的活性是明显升高的,这可能是由于合并CKD的OSA患者肾脏疾病不断进展所导致。
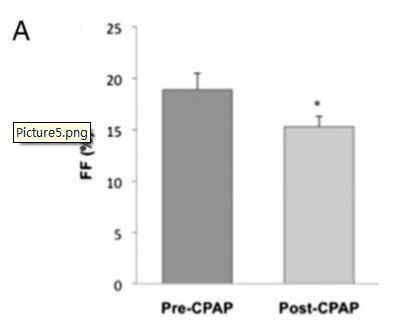
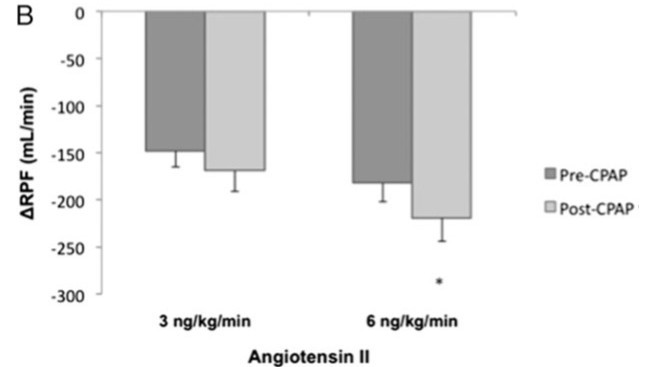
图5:表A表示了FF的变化清华,表B表示了对应用AngII后RPF在使用CPAP治疗前后的情况。FF = 滤过分数;RPF = 肾血流量。
总体来说,OSA在CKD患者中很常见,会导致肾脏疾病的进展。夜间低氧血症可作用在RAS系统或直接作用在肾脏上,通过数条通路导致肾脏疾病的进展(图6)。需进一步研究来明确特异性治疗是如何阻断这些通路以及这些治疗能否真正改善临床转归,如CKD的患病率和进展为ESKD。
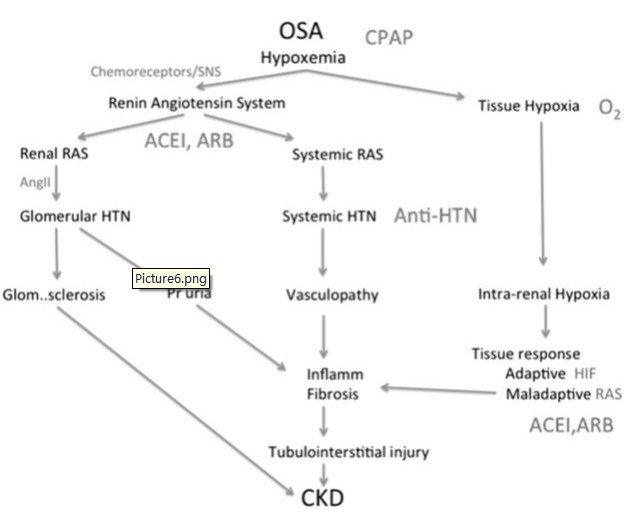
图6:OSA导致CKD的潜在通过和具体的干预措施(大写表示)。ACEI = 血管紧张素转换酶抑制剂;AngII = 血管紧张素II;Anti-HTN = 抗高血压药物;ARB = 血管紧张素受体拮抗剂;Glom..sclerosis = 肾小球硬化;HIF = 低氧诱导因素; HTN = 高血压;Inflamm = 炎症;Pruria = 蛋白尿;RAS = 肾素-血管紧张素系统;SNS = 交感神经系统。
摘自 丁香园
|

